СОДЕРЖАНИЕ
СПИСОК ПРИНЯТЫХ СОКРАЩЕНИЙ
ВВЕДЕНИЕ
1. ОБЗОР ЛИТЕРАТУРЫ
1.1 Общая характеристика диатомовых водорослей
1.2 Изучение генотипов у диатомовых водорослей
2.2 ОБЪЕКТЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
2.1 Объекты исследования
2.2 Методы исследования
2.2.1 Выделение ДНК
2.2.2 Амплификация фрагмента гена 18S рРНК
2.2.3 Амплификация фрагмента гена cox
2.2.3 Электрофорез в агарозном геле
2.2.5 Определение нуклеотидных последовательностей
2.2.6 Филогенетический анализ
3. РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
3.1 Анализ фрагментов гена 18 S рРНК
3.2 Анализ фрагментов гена cox1
ВЫВОДЫ
СПИСОК ИСПОЛЬЗОВАННОЙ ЛИТЕРАТУРЫ
ВВЕДЕНИЕ
Диатомовые водоросли (Bacillariophyta) – одноклеточные автотрофные эукариотические организмы, обитающие в морских и пресных водоемах. Диатомеи играют важную роль в первичной продукции и на их долю приходиться до 20 % общей первичной продукции Земли [42]. Отличительной чертой диатомовых водорослей являются их видоспецифичная клеточная стенка построенная из кремнезема [38].
Диатомеи являются основным составляющим бентосных и планктонных сообществ, которые встречаются в океанах, морях и пресных водах во всем мире [17], а также во влажных наземных биотопах [13].
Диатомовые водоросли используются в палеоэкологической реконструкции, стратиграфической корреляции и экологическом мониторинге [51], в котором необходима точная идентификация видов и знание аутэкологии вида [12].
На данный момент при изучении диатомовых водорослей остается проблема идентификации видов и определение видовых границ. При морфологическом анализе не всегда точно удается определить видовую принадлежность в связи с пластичностью фенотипических признаков, а также некоторые виды имеют очень сходное строение друг с другом, но генетически являются совершенно разными видами (криптические) [9].
Популяции диатомовых водорослей являются генетически неоднородными и представляют собой сочетание разных генотипов [7]. Генетическая гетерогенность поддерживается за счет полового процесса [49]. Предполагается, что это необходимо для более эффективной адаптации к изменениям окружающей среды [20]. Высокий уровень генетического разнообразия Thalassiosira gravida наблюдался во время всего цветения [6]. В настоящее время внутривидовая изменчивость пресноводных пеннатных диатомей изучена недостаточно.
Цель данной работы определение генетического разнообразия Ulnaria acus (Kützing) Aboal. на основе молекулярно-филогенетического анализа.
Были поставлены следующие задачи:
1. Подобрать условия амплификации и определить нуклеотидные последовательности фрагментов гена cox1 U. acus из различных мест обитания;
2. Амплифицировать и определить нуклеотидные последовательности V3-V4 петель гена 18S рРНК U. acus из различных мест обитания;
3. Провести филогенетический анализ полученных последовательностей генов cox1 и 18S рРНК U. acus из различных мест обитания.
1. ОБЗОР ЛИТЕРАТУРЫ
1.1 Общая характеристика диатомовых водорослей
Диатомовые водоросли – одноклеточные эукариотические фотосинтезирующие организмы, доминирующие в составе фитопланктона водоемов различного типа. Таким образом, они являются важной частью многих биоценозов и встречаются в озерных, морских и наземных экосистемах, а также в аэрозолях [13]. В водоемах диатомеи встречаются, как в виде планктона, который свободно дрейфует в толще воды, так и виде бентоса, прикрепленных к различным субстратам (например, камни, растения, песок, животные и т.д.) [35]. Температура при котором обитают диатомовые водоросли имеет достаточно широкий диапазон, некоторые виды обитают на нижней поверхности льда [22], а также встречаются виды живущие в горячих источниках при температуре до 70 ℃ [39].
Размеры диатомовых водорослей могут варьироваться от нескольких микрометров до 2 мм. Мелкоклеточные виды Stephanodiscus, Cyclotella, Minidiscus и Thalassiosira, могут достигать 3-5 мкм в диаметре. Самые крупные клетки центрического рода Ethmodiscus могут достигать 2 мм в диаметре [31].
Диатомеи играют важную роль в биогеохимических циклах углерода и кремния [43]. Вклад диатомовых водорослей в фиксацию углерода оценивается до 20 % первичной продукций Земли, что сопоставимо с тропическими лесами [31, 42]. По оценкам их вклад в круговорот кремния в среднем оценивается 150-210 Тмоль в год [44]. Кремний (Si) является вторым после кислорода по распространенности элементом земной коры со средним содержанием 27-29% от массы [60] и встречается в большом количестве минералов на поверхности планеты. В воде Si присутствует в виде кремниевой кислоты [57], и он является одним из важных биогенных элементов для диатомовых водорослей [46], высших растении семейств Equisetaceae и Chrysophyceae [16], радиолярии, хоанофлагеллят, губок и др. [25].
Клетки диатомовых водорослей покрыты видоспецифичным панцирем построенным из кремнезема (SiO2 • nH2O) [31], который не похож на другие структуры у встречающихся фотосинтезирующих организмов [2]. Кремнистая стенка диатомей состоит из двух перекрывающихся створок (тек) [41]. Одна из тек (эпитека) обычно немного больше и перекрывает другую теку (гипотеку) (рис. 1). Каждая из створок состоит из клапана и одного или нескольких закрытых или незамкнутых колец – поясковых ободков. Теки имеют поры или ареолы, которые формируют множество видоспецифичных орнаментов и перфораций [27].
Ядро диатомовых водорослей окружено ядерное оболочкой, такой же, как и у большинства эукариот [46]. Как показывают исследования мембранна ядра связана не только с мембранной эндоплазматического ретикулума (ЭПР), но также с внешней мембраной хлоропласта [5] (рис. 1). Такую разветвленную структуру мембран удалось визуализировать с помощью химерных белков ЭПР с зеленым флюоресцирующим белком (GFP) [24]. В работах по исследованию некоторых видов диатомовых водорослей было показано, что ядерная оболочка частично разрушается и в делении ядра, как и у других эукариот, принимают участия центры организации микротрубочек [32, 56]. У некоторых видов диатомовых водорослей аппарат Гольджи тесно связан с ЭПР и митохондриями, таким образом формируя единую сеть, или может окружать ядро, формируя около ядерную оболочку [33].
Хлоропласты диатомовых водорослей содержат хлорофиллы а и с, фукоксантин, каротиноидные пигменты (диатоксантин и диадиноксантин) [14]. В каждом хлоропласте присутствует один или несколько пиреноидов. Количество пиреноидов на хлоропласт, их структура и положения являются видоспецифичными для диатомей [58].
Полимеризация кремниевой кислоты и формирование створок диатомовых водорослей происходит в специализированной органелле SDV (silicon deposition vesicle — везикуле отложения кремнезема), которая образуется во время деления [59]. Во время вегетативного размножения гипотека материнской клетки становится эпитекой одной дочерней клетки. Таким образом, одна дочерняя клетка имеет тот же размер, что и родительская, а вторая меньше размером.
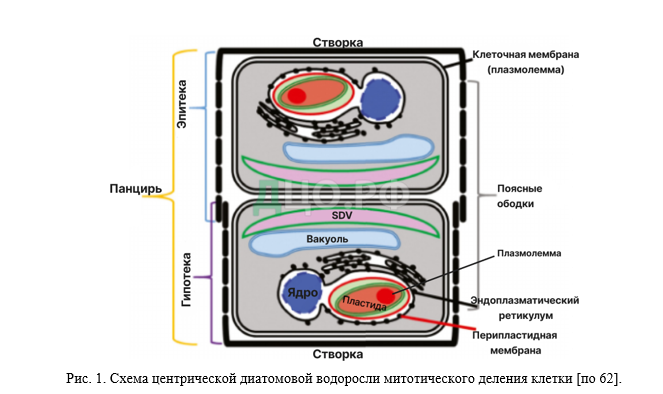
В результате митотического деления диатомовые водоросли достигают минимального размера клеток для данного вида размера. Этот и другие факторы (наличие полового партнера в случае раздельнополости, определенные температурные и световые условия) [1] инициируют начало полового процесса. Гаметы, образованные в результате оогамии, анизогамии или изогамии, отделяются от стенок родительских клеток и сливаются, образуя зиготу (ауксоспору), которая быстро. После окончания процесса роста внутри ауксоспоры образуется эпитека и гипотека, т.е. таким образом, формируется инициальная клетка, размеры которой обычно приближаются к максимально возможным для данного вида. Эти особенности уменьшения и восстановления размеров в сочетании с сильно орнаментированной кремнистой стенкой уникальны для диатомовых водорослей [30].
Диатомовые водоросли используются в качестве биоиндикаторов качества воды [52]. И их точное определение видов имеет решающее значение при оценке качества воды [8]. Диатомеи являются многочисленной группой микроводорослей, количество видов в настоящее время по данным AlgaeBase насчитывается около 18,3 тыс. видов (включая вымершие виды) [65]. Некоторые авторы предполагают, что количество видов диатомовых водорослеи может достигать от 100 000 до 200 000 с учетом криптических [29]. На основе симметрии створок диатомовые водоросли делят на две группы (пеннатные и центрические) [46] или три класса: Coscinodiscophyceae – центрические, Fragillariophyceae – пеннатные бесшовные, Bacillariophyceae – пеннатные шовные [46] (рис. 2).
Створки центрических имеют архитектуру, с центром симметрии (кольцом) в середине створки и рядами пор, расходящихся от кольца (радиально-центрические) или же имеют двух- или многополярные теки с удлиненным или искаженным кольцевым пространством (полярно-центрические) [46].
Пеннатные диатомовые водоросли двусторонне симметричны и вместо кольца имеют ребро, проходящее вдоль продольной оси каждой теки. У шовных пеннатных ребро содержит шов, который прерывается центральным узлом.
Рис. 2. Структура клеточных стенок диатомовых водорослей на примере четырех различных видов диатомей, СЭМ [46].
На основе филогенетического анализа маркерного гена 18S рРНК диатомовые водоросли были разделены на три класса: центрические (Coscinodiscophytina), мультиполярные центрические (Mediophyceae) и пеннатные (Bacillariophytina) [33]. Однако стоит отметить, что пеннатные диатомовые водоросли не формируют монофилетическую кладу [2].
Ген 18S рРНК кодирует РНК (SSU-рРНК) малой субъединицы рибосомы и является одним из часто используемым генетическим маркером для изучения молекулярной эволюции эукариот [23]. Преимущество использования этого гена может объясняться несколькими причинами: он присутствует во всех живых клетках; у него есть как консервативные, так и девять гипервариабельных регионов V1-V9, которые могут быть использованы для определения родовой или видовой принадлежности [61]; его функция остается постоянной на протяжении долгого времени; в геноме находится множество идентичных копий [11]. Как показывают исследования, использования V3-V4 вариабельных участков 18S рРНК обычно достаточно для видовой идентификации диатомовых водорослей имеющих разное систематическое положения [28]. За исключением рода Stephanodiscus Ehrenberg для определения видов которого, предлагается дополнительно использовать internal transcribed spacers (ITS) [63].
1.2 Изучение генотипов у диатомовых водорослей
Большое количество видов и достаточно широкий диапазон местообитаний диатомовых водорослей позволяет предположить, что они обладают высокой способностью к адаптации [53]. При благоприятных условиях среды происходит массовое развитие (“цветение”) отдельных видов или комплексов видов в водоеме. “Цветение” встречается, как в морских, так и пресноводных водоемах, в полярных и тропических, в эвтрофных, так и в олиготрофных типах водоемов [3, 6].
Генетическая изменчивость достигается в результате мутации и рекомбинации de novo, которая еще недостаточно изучена у диатомовых водорослей. Скорость мутации была определена только для пеннатного вида Phaeodactylum tricornutum и составила 4,810-10 сайт на поколение [26].
Скорость половой рекомбинации для разных видов диатомей оценивается от одного раза в год до одного раза в 40 лет [50]. В настоящее время непонятно какую экологическую роль играет “обычный” кроссинговер у этих организмов [53]. Известно, что у некоторых организмов (дрожжи, аскомицеты, оомицеты) у которых отсутствует “обычный” кроссинговер происходит митотический кроссинговер между гомологичными хромосомами в вегетативных клетках [36]. Предполагается, что митотический кроссинговер происходит на порядок чаще, чем “обычный” кроссинговер и это приводит к увеличению генетического разнообразия популяции при отсутствии полового процесса [53]. Недавно авторами на двух пеннатных видах (P. tricornutum и Seminavis robusta) было показано, что частота рекомбинации при митотическом кроссинговере составляет 4,2 события на 100 клеточных делении. Стоит отметить, что этот показатель увеличивался при стрессовых условиях культивирования. Таким образом, митотический кроссинговер может быть одним из адаптационных факторов для популяции диатомовых водорослей при резких изменениях условии окружающей среды [37] и служить основой для генетического разнообразия популяции.
Микросателлиты – это нейтральные маркеры, которые разбросаны по геномам эукариот, включая диатомовые водоросли , состоящие из ди-, три- или тетрануклеотидов, которые тандемно повторяются десятки-сотни раз и обычно расположенные в некодирующих участках генома [21]. Микросателлитные локусы являются одними из быстро эволюционирующих участков генома [18], а количество и длина повторов может выступать в качестве маркера позволяющего различать генетические варианты одного организма [47].
Исследование микросателлитных локусов у диатомовых водорослей показало высокий уровень генетического разнообразия в естественных условиях. Так анализ данного локуса в течении нескольких лет популяции диатомовой водоросли Ditylum brightwellii из фьордов Каскадии (Северная Америка) [48, 49] показал, что генотипы D. brightwellii имели разную скорость деления в зависимости от интенсивности света [49]. Последующая работа выявила, что разные популяции были связаны с различными уровнями питательных веществ и интенсивности света. Авторы предполагают, что существует фенотипическая дивергенция между различными популяциями в природе [48]. Исследование микросателлитных маркеров для изучения структуры популяции D. brightwellii [47] положило начало разнообразным исследованиям по популяционной генетики диатомовых водорослей [53].
В различных работах авторами было показано, что популяции диатомовых водорослей состоят из различных генотипов, число которых может быть от пары десятков до сотни [54]. Для определения генотипов в популяции диатомовых водорослей, некоторые авторы используют фрагмент гена cox1 [15], поскольку по сравнению с другими маркерными генами: рибулозобисфосфаткарбоксилазы (rbcL), ITS, V3-V4 18S рРНК, cox1 показал самый высокий уровень дивергенции [8]. Филогенетический анализ фрагмента гена сох1 позволяет различать генотипы одного и того же вида диатомовых водорослей, выделенные из географически удаленных точек [15, 4]. Следует отметить, что гетерогенность популяций пресноводных пеннатных видов изучена слабо. Таким образом, используя фрагмент гена cox1, возможно провести анализ гетерогенности популяции вида Ulnaria acus (Ktzing) M. Aboal, как доминирующего представителя альгофлоры пресноводных водоемов.
2.2 ОБЪЕКТЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
2.1 Объекты исследования
Объектом данной работы являлся вид диатомовой флоры географически удаленных пресных водоемов: оз. Байкал (Россия), оз. Рица (Абхазия), оз. Голубое (Абхазия).
Класс пеннатные бесшовные – Fragillariophyceae, Haeckel
подк. Fragilariophycidae, Round
пор. Licmophorales, Round
сем. Ulnariaceae, E.J.Cox
род Ulnaria, (Kützing) Compère
вид Ulnaria acus (Ktzing) M.Aboal, 2003 клетки вытянутые, створки имеют линейно-ланцетную форму, к концам постепенно суженные, 90,5-143,8 мкм длиной, 3-5,71 мкм шириной, штрихов 40-60 в 10 мкм. Осевое поле узкое линейное, среднее удлиненно четырехугольное (рис. 3,4).
Рис. 3. U. acus, световая микроскопия. Шкала: А — 50 мкм, Б — 10 мкм (автор фотографии к.б.н., с.н.с. Бедошвили Е.Д.).
Рис. 4. U. acus, СЭМ. А – базальный конец створки на рисунке (стрелкой указано расположение оцеллюлимбуса); Б – базальный конец створки (стрелкой указано расположение римопортулы); В – элемент центрального поля на рисунке; Г – элемент базального конца створки на рисунке (стрелкой указано расположение оцеллюлимбуса); Д – створка без вершинных шипов, вид снаружи. Шкала: А-Г — 1 мкм; Д — 10 мкм [12].
В работе было использовано 15 моноклональных штаммов диатомовых водорослей из оз. Байкал (коллекция Отдела Ультраструктуры клетки ЛИН СО РАН), а также 12 штаммов из Коллекции диатомовых водорослей Мирового океана (WODC) Карадагской научной станции (Россия), отобранные в оз. Рица и оз. Голубого (табл., рис. 5). Культивирование проводилось в ДМ — среде [55] в 100 мл конические колбах Эрленмейера в холодильных шкафах, оснащенных лампами с контролируемым режимом освещения и температурным режимом 8°С.
Таблица
Данные о моноклональных штаммах из коллекций используемые в работе
| № | Название штамма | Место отбора проб |
| 1 | BZ 5 | Россия, оз. Байкал, Баргузинский залив |
| 2 | ММ118 | Россия, оз. Байкал, недалеко от м. Зундук |
| 3 | MS278 | Россия, оз. Байкал, разрез Маритуй-Солзан центр |
| 4 | L549 | Россия, оз. Байкал, недалеко от п. Листвянка |
| 5 | 5KH 561 | Россия, оз. Байкал, 5 км от протока Харауза, дельта р. Селенга |
| 6 | T-N 579 | Россия, оз. Байкал, разрез Тыя — Немнянка центр |
Продолжение таблицы
| 7 | B-T 577 | Россия, оз. Байкал,разрез Байкальский — Турали центр |
| 8 | Ykh-T581 | Россия, оз. Байкал, разрез Ухан — Тонкий центр |
| 9 | 15K 588 | Россия, оз. Байкал, 15 км от р.п. Култук |
| 10 | 15K 589 | Россия, оз. Байкал, 15 км от р.п. Култук |
| 11 | Y-T 594 | Россия, оз. Байкал, разрез Ухан — Тонкий центр |
| 12 | L-T 600 | Россия, оз. Байкал, разрез Листвянка-Танхой- центр |
| 13 | L-T 604 | Россия, оз. Байкал, разрез Листвянка-Танхой- центр |
| 14 | B-T 605 | Россия, оз. Байкал, разрез Байкальское-Турали центр |
| 15 | Mar-S 607 | Россия, оз. Байкал, разрез Маритуй — Солзан центр |
| 16 | Г.21.0309-ОЕ_1 | Абхазия, оз. Голубое |
| 17 | Р.21.0309-ОЕ | Абхазия, оз.Рица |
| 18 | Г.21.0309-ОС | Абхазия, оз. Голубое |
| 19 | Г.21.0309-ОЕ_4 | Абхазия, оз. Голубое |
| 20 | Г.21.0309-ОF | Абхазия, оз. Голубое |
| 21 | P.21.0309-ОQ | Абхазия, оз.Рица |
| 22 | Г.21.0309-ОG | Абхазия, оз. Голубое |
| 23 | Г.21.0309-ОЕ | Абхазия, оз. Голубое |
| 24 | P.21.0309-ОI | Абхазия, оз.Рица |
| 25 | P.21.0309-ОЕ1 | Абхазия, оз.Рица |
| 26 | P.21.0309-001 | Абхазия, оз.Рица |
| 27 | P.21.0309-ОA1 | Абхазия, оз.Рица |
Рис. 5. Места отбора штаммов. А- карта мира, Б- карта оз. Байкал (синий- оз. Байкал, Россия, зеленый- оз. Рица, оз. Голубое, Абхазия).
2.2 Методы исследования
2.2.1 Выделение ДНК
Выделение ДНК из клеток проводили по следующей методике. Биомассу клеток диатомовых водорослей концентрировали из среды с помощью центрифугирования на Allegra X-12R (Beckman Coulter, США) при 3720 g, 4 °С в течении 20 мин, а затем замораживали -70 ℃. Замороженные концентрированные клетки диатомей оттаивали при комнатной температуре, добавляли лизирующий буфер (20 мМ Tрис-HCl pH 8,0, 100 мМ NaCl, 50 мМ ЭДТА) из расчета 450 мкл на 100-200 мг клеток, 50 мкл 10% ДДС-Na, 15 мкл 10 мг/мл протеиназы К и инкубировали 2 ч., при температуре 55 ℃ с периодическим перемешиванием. Экстракцию ДНК проводили 800 мкл фенола насыщенного Трис-буфером pH 8,0 в течении 10 мин. и центрифугировали 10 мин при 16100 g. Супернатант экстрагировали смесью фенолом-хлороформом-изоамиловый спирт (25:24:1) 10 мин. и при тех же условиях. Супернатант экстрагировали равным объемом смеси хлороформа-изоамиловый спирт (24:1), перемешивали и центрифугировали, как описано ранее. Для осаждения ДНК добавляли 1/10 от объема пробы 3 М ацетата натрия pH 5,2 и 2 объема этанола и выдерживали при -20 ℃ в течение ночи. ДНК осаждали в течение 30 мин. при 16100 g, при 0℃. Осадок дважды промывали 700 мкл 70 % этанола с центрифугированием в течение 15 мин 16100 g, при 0 ℃. Осадок высушивали на воздухе при комнатной температуре и растворяли в 100 мкл буфера TE (10 мМ Трис-HCl. 0,1 мМ ЭДТА, pH 8.0). Концентрацию ДНК определяли спектрофотометрически на спектрофотометре Eppendorf BioSpectrometer (Eppendorf AG, Германия), измеряя поглощение при длинах волн 260, 280 нм.
2.2.2 Амплификация фрагмента гена 18S рРНК
Амплификацию фрагмента гена 18S рРНК проводили используя пару праймеров 18S_1F 5’– AACCTGGTTGATCCTGCCAGT-3’ [40] и 18S_1050R 5’– GTTTCAGHCTTGCGACCATACTCC-3’ [8] с помощью набора БиоЛабМикс (Россия), который содержал на 20 мкл: 5хПЦР буфер (+MgCl2) 4 мкл , 50х смесь dNTP 0,4 мкл, 50мМ MgCl2 1,1 мкл, праймеры с концентрацией 10 мкМ по 0,4 мкл, ДНК-матрица 0,8 мкл, HS-Taq ДНК-полимераза 0,4 мкл, стерильной воды 12,5 мкл.
Температурный профиль ПЦР реакции: предварительная денатурация 5 мин. при 95 ℃, далее 35 циклов (30 с при 95 ℃, 30 с при 60 ℃, 1,1 мин при 72 ℃), финальный этап элонгации 3 мин при 72 ℃.
2.2.3 Амплификация фрагмента гена cox1
Для проведения амплификации фрагмента гена cox1 использовали праймеры cox1_1F 5’-ATGAAGTTTGCTAATCGATGGT-3’ и cox1_714R 5’-AAAAAGGTGTTGGAACAGTACAG-3’ [19] и проводила с помощью: предварительная денатурация 3 мин. при 95 ℃, далее 37 циклов (30 с при 95 ℃, 4 мин при 56,8 ℃, 45 с при 72 ℃), после 3 мин при 72℃.
2.2.3 Электрофорез в агарозном геле
Продукты амплификации визуализировали методом горизонтального электрофореза в 1% агарозном геле. В качестве буфера-электролита использовали х1 ТАЕ — буфер (40 мМ Трис; 20 мМ уксусная кислота; 1 мМ ЭДТА), с добавлением этидия бромида до концентрации 0,3 мг/мл в качестве интеркалирующего красителя. Длину ПЦР-фрагментов определяли по скорости их миграции в геле, сопоставляя с маркером DNA Ladder 1 kb (Евроген, Россия).
Препаративный электрофорез выполнялся методом горизонтального электрофореза на 0,5-0,6% агарозном геле, при использовании агарозы Centrified Megabase (Bio-Rad, США) и х0,5 ТАЕ буфере с добавлением этидия бромида, как описано выше.
2.2.5 Определение нуклеотидных последовательностей
Продукты амплификации секвенировали (к.б.н., н.с. Марченков А.М.) с помощью BigDye 3.1 (Applied Biosystems, USA) и анализировали на Нанофор 05 (Синтол, Россия) в ЦКП «Ультрамикроанализа» ЛИН СО РАН, г. Иркутск.
2.2.6 Филогенетический анализ
Нуклеотидные последовательности маркерных генов 18S и cox1, сравнивались с последовательностями из базы данных NCBI. Выравнивание набора нуклеотидных последовательностей проводилось в программе BioEdit (7.7.1) Построение филогенетического дерева осуществлялось в программе MEGA 6.0 [34] Наилучшая модель нуклеотидных замен была найдена с использованием MEGA 6.0 [34]. Деревья максимального правдоподобия, построенные с использованием моделей для 18S рРНК TN93 (Tamura-Nei model) c гамма распределением (G), для cox1 T92 (Tamura 3-parameter model) с гамма распределением и консервативным основанием (G+I). Достоверность ветвления была рассчитана с использованием 1000 реплик с поддержкой бутстрепа [64].
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
3.1 Анализ фрагментов гена 18 S рРНК
При работе со штаммами, отнесенных к роду Ulnaria по данным световой микроскопии, предварительно подбирали температуру гибридизации праймеров 18S_1F и 18S_1050R для амплификации фрагмента гена 18S рРНК (~1000 п.н.) содержащего вариабельные регионы V3-V4 (рис. 6). В результате оптимальной температурой для гибридизации данной пары праймеров решено было считать – 60 ℃.
Рис. 6. Электрофореограмма в 1,3 % агарозном геле продуктов амплификации фрагмента гена 18S рРНК используя температурный градиент:1 – 53℃, 2 – 56,1℃, 3 – 60℃, 4 – 62,6℃, 5 – 66℃, маркер DNA Ladder 1 kb (Евроген, Россия).
Подобранные условия амплификации использовались для получения ампликонов 18S рРНК для всех исследуемых штаммов. Определения нуклеотидных последовательностей проводили с использованием праймера 18S_1050R. В результате было получено 15 фрагментов генов 18S рРНК из оз. Байкал (Россия) и 12 фрагментов из оз. Рица (Абхазия) и оз. Голубого (Абхазия).
Филогенетический анализ фрагментов генов 18S рРНК показал, что все последовательности штаммов из оз. Байкал (Россия), оз. Рица и с оз. Голубого (Абхазия) образуют одну кладу с высокой степенью поддержки (99%), которая принадлежит роду Ulnaria (рис. 7). Клада Ulnaria содержит подкладу с степенью поддержки (85%), которая относится к видам U. ulna и U. danica, а также клада в которой находятся последовательности преимущественно относящиеся к U. acus (рис. 7). Полученные данные согласуются с результатами, которые были получены ранее в работах [12, 19].
Рис. 7. Филогенетическое дерево фрагментов гена 18S рРНК содержащий вариабельные регионы V3-V4. Филогенетический анализ проведен методом максимального правдоподобия (Maximum Likelihood) с помощью модели TN93+G. В узлах дерева приведены бустреп-значения, полученные при n=1000 реплик. Треугольниками отмеченные последовательности полученные в данной работе (синий — Россия, оз. Байкал; зеленый — Абхазия, оз. Рица, оз. Голубое).
Следует отметить, что штамм MS278 из оз. Байкал (Россия) при формировании коллекции культур был отнесен к роду Ulnaria, однако, во время секвенирования было показано, что он относится к Fragilaria radians (см. рис. 7). Некоторые рода Ulnaria и Fragilaria являются близкородственными и некоторые из видов имеют перекрывающиеся морфологические признаки, что затрудняет точность определения систематического положения представителей данных родов только посредствам световой микроскопии. Таким образом, точная видовая идентификация таких видов как U. acus и F. radians невозможна без использования сканирующей электронной микроскопий или молекулярно-биологического анализа маркерных генов [12].
3.2 Анализ фрагментов гена cox1
С целью определения генетического разнообразия штаммов, отнесенных по данным анализа 18S рРНК к виду U. acus были подобраны условия амплификации фрагмента гена cox1 (~750 п.н.) с праймерами cox1_1F и cox1_714R (рис. 8). Определения нуклеотидных последовательностей проводили с использованием праймера cox1_714R.
Рис. 8. Электрофореограмма в 1,5 % агарозном геле продуктов амплификации фрагмента гена cox1 в градиенте температур отжига:1- 52 ℃, 2-53,5℃, 3- 56,8 ℃,4-58,9 ℃, 5- 63℃ , маркер DNA Ladder 1 kb (Евроген, Россия).
С помощью филогенетического анализа фрагментов гена cox1 штаммов U. acus было показано формирование трех клад (рис. 9). Клада 1 включает в себя штаммы, которые были выделены из проб отобранных из оз. Рица (Абхазия), оз. Байкал (Россия), оз. Фролиха (Россия). Клада 2 содержит последовательности штаммов из трех географически удаленных водоемов: оз. Голубое (Абхазия), оз. Байкал (Россия), р. Эрдер (Франция). Штамм U. acus выделенный из оз. Матана (Индонезия) формирует отдельную 3 кладу. Результаты филогенетического анализа фрагментов гена cox1 штаммов U. acus согласуются с ранее полученными [19].
Рис. 9.Филогенетическое дерево фрагментов гена cox1. Анализ проведен методом максимального правдоподобия (Maximum Likelihood) с помощью модели T92+G+I. В узлах дерева приведены бустреп-значения, полученные при n=1000 реплик. Треугольниками отмеченные последовательности полученные в данной работе (синий — Россия, оз. Байкал; зеленый — Абхазия, оз. Рица, оз. Голубое) .
Географически оз. Рица и оз. Голубое удалены друг от друга на расстоянии 17,5 км. Два штамма выделенные из пробы фитопланктона оз. Рица принадлежат к 1 кладе. В свою очередь штамм Г.21.0309-OC выделенный из оз. Голубое принадлежит ко 2 кладе. Однако, для того, чтобы говорить об однородности популяции в оз. Рица и оз. Голубое в настоящее время мы имеем недостаточное количество данных.
Используя филогенетический анализ фрагментов гена cox1 было показано, что штаммы U. acus 15K588 и 15K589 выделены из пробы фитопланктона отобранной в 15 км от р.п. Култук оз. Байкал относятся к разным кладам. На основе полученных данных можно сделать предположение, что штаммы 15K588 и 15K589 относятся к разным генотипам одного вида, и что популяция U. acus в данной точке отбора является гетерогенной. Полученные в работе результате поддвержают ранее полученные данные о гетерогенности популяции U. acus в оз. Байкал [19]. Ранее возможность гетерогенности популяции диатомей была показана для других видов используя маркерные гены cox1, ITS1-5,8S-ITS2 и микросателлиты [15, 10, 45].
ВЫВОДЫ
- Анализ фрагмента гена 18S рРНК содержащего вариабельные регионы V3-V4 показал, что среди 27 моноклональных штаммов 11 относятся к виду Ulnaria acus (Kützing) Aboal. и 1 штамм — Fragilaria radians. Штаммы отнесенные к комплексу Ulnaria ulna и Ulnaria danica требуют дополнительных исследований с применением других генетических маркеров для установления точной видовой принадлежности.
- Анализ фрагмента гена cox1 у штаммов Ulnaria acus (Kützing) Aboal. показал гетерогенность популяции данного вида.
СПИСОК ИСПОЛЬЗОВАННОЙ ЛИТЕРАТУРЫ
- Подунай Ю. А. Половое воспроизведение, система скрещивания и биогеография представителей рода Ulnaria (KÜTZING) COMPÈRE (Bacillariophyta) : Биол. исслед. : дис. канд. биол. наук : 01.05.16 / Ю. А. Подунай ; Институт биологии южных морей имени А.О.Ковалевского РАН – Севастополь, 2022. – 157 с.
- A preliminary multigene phylogeny of the diatoms (Bacillariophyta): challenges for future research / E. C. Theriot [et al.] // Plant Ecology and Evolution. – 2010. – V. 143, N. 3. – P. 278-296. – https://doi.org/10.5091/plecevo.2010.418.
- Armbrust E. V. The life of diatoms in the world’s oceans / E. V. Armbrust // Nature. – 2009. – V. 459, N. 7244. – P. 185-192.
- Barcoding diatoms: exploring alternatives to COI-5P / S. E. Hamsher [et al.] // Protist. – 2011. – V. 162, N. 3. – P. 405-422. – https://doi.org/10.1016/j.protis.2010.09.005.
- Cavalier-Smith T. Membrane heredity and early chloroplast evolution/ T. Cavalier-Smith // Trends in plant science. – 2000. – V. 5, N. 4. – P. 174-182.
- Chen G. Genetically distinct populations of a diatom co‐exist during the North Atlantic spring bloom / G. Chen, T. A. Rynearson // Limnology and Oceanography. – 2016. – V. 61, N. 6. – P. 2165-2179.
- Company matters: The presence of other genotypes alters traits and intraspecific selection in an Arctic diatom under climate change/ K. K. E. Wolf [et al.] // Global change biology. – 2019. – V. 25, N. 9. – P. 2869-2884. – https://doi.org/10.1111/gcb.14675.
- Comparison of potential diatom ‘barcode’genes (the 18S rRNA gene and ITS, COI, rbcL) and their effectiveness in discriminating and determining species taxonomy in the Bacillariophyta / L. Guo [et al.] // International journal of systematic and evolutionary microbiology. – 2015. – V. 65, N. Pt_4. – P. 1369-1380. – https://doi.org/10.1099/ijs.0.000076.
- Cryptic and pseudo‐cryptic diversity in diatoms—with descriptions of Pseudo‐nitzschia hasleana sp. nov. and P. fryxelliana sp. nov. 1 / N. Lundholm [et al.] // Journal of Phycology. – 2012. – V. 48, N. 2. – P. 436-454. – https://doi.org/10.1111/j.1529-8817.2012.01132.x.
- Cryptic diversity in a cosmopolitan diatom known as Asterionellopsis glacialis (Fragilariaceae): Implications for ecology, biogeography, and taxonomy / I. Kaczmarska [et al.] // American Journal of Botany. – 2014. – V. 101, N. 2. – P. 267-286. – https://doi.org/10.3732/ajb.1300306.
- Database on the structure of small ribosomal subunit RNA / Y. Van de Peer [et al.] // Nucleic Acids Research. – 1998. – V. 26, N. 1. – P. 179-182. – https://doi.org/10.1093/nar/26.1.179.
- Delimitation of some taxa of Ulnaria and Fragilaria (Bacillariophyceae) based 6on genetic, morphological data and mating compatibility / Y. Zakharova [et al.] // Diversity. – 2023. – V. 15, N. 2. – P. 271. – https://doi.org/10.3390/d15020271.
- Diatoms and DNA barcoding: A pilot study on an environmental sample / R. Jahn [et al.] // Proceedings of the 1st Central European diatom meeting. – Berlin‐Dahlem : Botanic Garden and Botanical Museum Berlin‐Dahlem, Freie Universität Berlin, 2007. – P. 63-68. – https://doi.org/3372/cediatom.113.
- Egeland, E. S. Carotenoids./ In M. A. Borowitzka, J. Beardall, & J. A. Raven (Eds.) // Thephysiology of microalgae Cham: Springer – 2016 – P. 507–563.
- Ehara M. Distribution of cognates of group II introns detected in mitochondrial cox1 genes of a diatom and a haptophyte / M. Ehara, K. I. Watanabe, T. Ohama // Gene. – 2000. – V. 256, N. 1-2. – P. 157-167.
- Epstein E. Silicon / E. Epstein // Annual review of plant biology. – 1999. – V. 50, N. 1. – P. 641-664.
- Finlay B. J. Hypothesis: the rate and scale of dispersal of freshwater diatom species is a function of their global abundance / B. J. Finlay, E. B. Monaghan, S. C. Maberly // Protist. – 2002. – V. 153, N. 3. – P. 261-273.
- Freeland J. R. Molecular ecology ./ Freeland J. R – John Wiley & Sons, 2020. – p. 384.
- Genotypic diversity of Ulnaria acus (Kützing) Aboal from Eurasia / A. M. Marchenkov [et al.] // Limnology and Freshwater Biology. – 2022. – V. 6. – P. 1705-1711. – https://doi.org/10.31951/2658-3518-2022-A-6-1705.
- Godhe A. The role of intraspecific variation in the ecological and evolutionary success of diatoms in changing environments / A. Godhe , T. Rynearson // Philosophical Transactions of the Royal Society B: Biological Sciences. – 2017. – V. 372, N. 1728. – P.
- Goldstein D. B. Launching microsatellites: a review of mutation processes and methods of phylogenetic inference / D. B. Goldstein, D. D. Pollock // Journal of heredity. – 1997. – V. 88, N. 5. – P. 335-342.
- Gutt J. The occurrence of sub-ice algal aggregations off northeast Greenland / J. Gutt // Polar Biology. – 1995. – V. 15. – N. 247-252.
- Hillis D. M. Ribosomal DNA: molecular evolution and phylogenetic inference / D. M. Hillis, M. T. Dixon // The Quarterly review of biology. – 1991. – V. 66, N. 4. – P. 411-453.
- In vivo characterization of diatom multipartite plastid targeting signals / K. E. Apt [et al.] // Journal of Cell Science. – 2002. – V. 115, N. 21. – P. 4061-4069. – https://doi.org/10.1242/jcs.00092.
- Knoll A. H. Biomineralization and evolutionary history / A. H. Knoll // Reviews in mineralogy and geochemistry. – 2003. – V. 54, N. 1. – P. 329-356.
- Krasovec M. First estimation of the spontaneous mutation rate in diatoms / M. Krasovec, S. Sanchez-Brosseau, G. Piganeau // Genome biology and evolution. – 2019. – V. 11, N. 7. – P. 1829-1837.
- Kröger N. Diatoms—from cell wall biogenesis to nanotechnology / N. Kröger, N. Poulsen // Annual review of genetics. – 2008. – V. 42. – P. 83-107.
- Luddington I. A. Distance and character-based evaluation of the V4 region of the 18S rRNA gene for the identification of diatoms (Bacillariophyceae) / I. A. Luddington, I. Kaczmarska, C. Lovejoy // PloS one. – 2012. – V. 7, N. 9. – P. e45664.
- Mann D. G. An inordinate fondness? The number, distributions, and origins of diatom species / D. G. Mann, P. Vanormelingen // Journal of eukaryotic microbiology. – 2013. – V. 60, N. 4. – P. 414-420.
- Mann D. G. The origins of the diatom and its life cycle / D. G. Mann // The chromophyte algae: problems and perspectives. – 1989. – V. 38. – P. 307-323.
- Mann D. G. Bacillariophyta / D. G. Mann, R. M. Crawford, F. E. Round – Handbook of the Protists. – 2016. – p. 205–266.
- Manton I. Observations on the fine structure and development of the spindle at mitosis and meiosis in a marine centric diatom (Lithodesmium undulatum) II. The early meiotic stages in male gametogenesis / I. Manton, K. Kowallik, H. A. Von Stosch // Journal of cell science. – 1969. – V. 5, N. 1. – P. 271-298.
- Medlin L. K. Evolution of the diatoms: V. Morphological and cytological support for the major clades and a taxonomic revision / L. K. Medlin, I. Kaczmarska // Phycologia. – 2004. – V. 43, N. 3. – P. 245-270.
- MEGA6: molecular evolutionary genetics analysis version 6.0 / K. Tamura [et al.] // Molecular biology and evolution. – 2013. – V. 30, N. 12. – P. 2725-2729. – https://doi.org/10.1093/molbev/mst197.
- Metabarcoding vs. morphological identification to assess diatom diversity in environmental studies / J. Zimmermann [et al.] // Molecular ecology resources. – 2015. – V. 15, N. 3. – P. 526-542. – https://doi.org/10.1111/1755-0998.12336.
- Mitotic recombination and rapid genome evolution in the invasive forest pathogen Phytophthora ramorum/ Dale A. L. [et al.] // MBio. – 2019. – V. 10, N. 2. – P. e02452-18. – https://doi.org/10.1128/mBio.02452-18.
- Mitotic recombination between homologous chromosomes drives genomic diversity in diatoms / P. Bulankova [et al.] // Current Biology. – 2021. – V. 31, N. 15. – P. 3221-3232. – https://doi.org/10.1016/j.cub.2021.05.013.
- Müller N. G. Dynamic interaction of object-and space-based attention in retinotopic visual areas / N. G. Müller, A. Kleinschmidt // Journal of Neuroscience. – 2003. – V. 23, N. 30. – P. 9812-9816.
- Nikulina T. V., Kociolek J. P., Diatoms from hot springs from Kuril and Sakhalin Islands (Far East, Russia) / J. Seckbach, P. Kociolek (eds) // The Diatom World. Cellular Origin, Life in Extreme Habitats and Astrobiology. Springer, Dordrecht, 2011. – P. 333-363.
- Phylogenetic position of Koliella (Chlorophyta) as inferred from nuclear and chloroplast small subunit rDNA / A. Katana [et al.] // Journal of phycology. – 2001. – V. 37, N. 3. – P. 443-451. – https://doi.org/10.1046/j.1529-8817.2001.037003443.x.
- Pickett-Heaps J. The cell biology of diatom valve formation / Pickett- J. Heaps // Progress in phycological research. – 1990. – V. 7. – P. 1-168.
- Primary production of the biosphere: integrating terrestrial and oceanic components / C. B. Field [et al.] // Science. – 1998. – V. 281. – P. 237-240. – https://doi.org/1126/science.281.5374.237.
- Primary productivity of planet earth: biological determinants and physical constraints in terrestrial and aquatic habitats / R. J. Geider [et al.] // Global change biology. – 2001. – V. 7, N. 8. – P. 849-882. – https://doi.org/1046/j.1365-2486.2001.00448.x.
- Production and dissolution of biogenic silica in the ocean: revised global estimates, comparison with regional data and relationship to biogenic sedimentation / D. M. Nelson [et al.] // Global biogeochemical cycles. – 1995. – V. 9, N. 3. – P. 359-372. – https://doi.org/10.1029/95GB01070.
- Revealing environmentally driven population dynamics of an Arctic diatom using a novel microsatellite PoolSeq barcoding approach / K. K. E. Wolf [et al.] // Environmental Microbiology. – 2021. – V. 23, N. 7. – P. 3809-3824. – https://doi.org/10.1111/1462-2920.15424.
- Round F. E. Diatoms: biology and morphology of the genera./ F. E. Round, R. M. Crawford, D. G. Mann – Cambridge university press, 1990. – p. 747.
- Rynearson T. A. DNA fingerprinting reveals extensive genetic diversity in a field population of the centric diatom Ditylum brightwellii / T. A. Rynearson, E. V. Armbrust // Limnology and Oceanography. – 2000. – V. 45, N. 6. – P. 1329-1340.
- Rynearson T. A. Spring bloom development, genetic variation, and population succession in the planktonic diatom Ditylum brightwellii / T. A. Rynearson, J. A. Newton, E. V. Armbrust // Limnology and Oceanography. – 2006. – V. 51, N. 3. – P. 1249-1261.
- Rynearson T. A.. Genetic differentiation among populations of the planktonic marine diatom ditylum brightwellii (bacillariophyceae) 1 / T. A. Rynearson, E. V. Armbrust // Journal of Phycology. – 2004. – V. 40, N. 1. – P. 34-43.
- Sex in marine planktonic diatoms: insights and challenges / M. Montresor [et al.] // Perspect. Phycol. – 2016. – V. 3, N. 2. – P. 61-75. – https://doi.org/1127/pip/2016/0045.
- Smol J. P. The diatoms: applications for the environmental and earth sciences. / J. P. Smol, E. F. Stoermer (ed.) – Cambridge University Press, 2010 – p. 611.
- Stevenson R. J. Understanding effects of global change on river ecosystems: science to support policy in a changing world / R. J. Stevenson, S. Sabater // Hydrobiologia. – 2010. – V. 657. – P. 3-18.
- Mock, T. [et al]. Structure and Evolution of Diatom Nuclear Genes and Genomes. / A. Falciatore, T. Mock (eds) // The Molecular Life of Diatoms : Springer, Cham., 2022. – P. 111-145.
- Temporal changes in population structure of a marine planktonic diatom / S. V. M. Tesson [et al.] // PLoS One. – 2014. – V. 9, N. 12. – P. – https://doi.org/10.1371/journal.pone.0114984
- Thompson A.S. Culture Collection of Algae and Protozoa. Catalogue of strains / A.S. Thompson, J.C. Rhodes, I. Pettman // Natural Environment Research and Council. England. – 5th edit., 1988. – P. 164.
- Tippit D. H. Mitosis in the pinnate diatom surirella ovalis / D. H. Tippit, J. D. Pickett-Heaps // The Journal of cell biology. – 1977. – V. 73, N. 3. – P. 705-727.
- Tracing the origin of dissolved silicon transferred from various soil-plant systems towards rivers: a review / Cornelis J. T. [et al.] // Biogeosciences. – 2011. – V. 8, N. 1. – P. 89-112. – https://doi.org/10.5194/bg-8-89-2011.
- Van den Hoek Ostende L. W. Insectivore faunas from the Lower Miocene Anatolia. Part 2: Dinosorex (Heterosoricidae) / L. W. van den Hoek Ostende // Proceedings of the Koninklijke Academie van Wetenschappen. – 1995. – V. 98, N. 1. – P. 1-18.
- Volcani B. E. Cell wall formation in diatoms: morphogenesis and biochemistry / B. E. Volcani // Silicon and siliceous structures in biological systems. – 1981. – P. 157-200.
- Wedepohl K. H. The composition of the continental crust / K. H. Wedepohl // Geochimica et cosmochimica Acta. – 1995. – V. 59, N. 7. – P. 1217-1232.
- Wright A. D. G. Maximum ages of ciliate lineages estimated using a small subunit rRNA molecular clock: Crown eukaryotes date back to the Paleoproterozoic/ A. D. G. Wright, D. H. Lynn // Archiv für Protistenkunde. – 1997. – V. 148, N. 4. – P. 329-341.
- Yee D. P. Dynamic subcellular translocation of V‐type H+‐ATPase is essential for biomineralization of the diatom silica cell wall / D. P. Yee, M. Hildebrand, M. Tresguerres // New Phytologist. – 2020. – V. 225, N. 6. – P. 2411-2422.
- Zimmermann J. Barcoding diatoms: evaluation of the V4 subregion on the 18S rRNA gene, including new primers and protocols / J. Zimmermann, R. Jahn, B. Gemeinholzer // Organisms Diversity & Evolution. – 2011. – V. 11. – P. 173-192.
- Zuckerkandl E. Evolutionary divergence and convergence in proteins / E. Zuckerkandl, L. Pauling // Evolving genes and proteins. – Academic Press, 1965. – P. 97-166.
- Guiry, M.D., Guiry, G.M. 2023. AlgaeBase.World-wide electronic publication, National University of Ireland, Galway. [Электронный ресурс] Режим доступа : https://www.algaebase.org (Дата обращения: 13.04.2023 г.).
