ВВЕДЕНИЕ…
Физико-химические основы процесса…
Технологическая схема и описание…
Расчет материального баланса…
Тепловой расчет…
Термодинамический расчет…
ЗАКЛЮЧЕНИЕ……
СПИСОК ЛИТЕРАТУРЫ……
ВВЕДЕНИЕ
Большинство работ в области химии стирола относится к 30-м и 40-м годам текущего столетия, т.е. к тому времени, когда усиленно развивалась промышленность пластических масс. С тех пор число исследований, посвященных получению стирола, его полимеризации и сополимеризации с другими непредельными соединениями, продолжает расти из года в год. Неослабевающий интерес к этому веществу объясняется тем, что все большее число отраслей промышленности применяет полистирол. Требования к его качеству также возрастают: полистирол с низким молекулярным весом, не обладающий достаточной термоустойчивостью, оказывается во многих случаях непригодным; повышаются требования к диэлектрическим свойствам полимера, зависящим в большой степени от чистоты мономера и метода полимеризации; требуется также улучшение механических свойств полимера. [1]
Предел возможного улучшения качества полимера не достигнут, так же как не исчерпаны еще и все возможные пути синтеза мономера. Указанные причины вызывают особый интерес к химии стирола и определяют три важнейших направления научно-исследовательской работы:
1. Поиски методов полимеризации, приводящих к образованию высокомолекулярных полимеров.
2. Получение полимеров из алкил- и галоидостиролов.
3. Сополимеризация стирола с рядом других, способных к полимеризации непредельных соединений.
Целью дaнного проектa являются: выбор и технико-экономическое обосновaние технологической схемы получения стирола дегидратацией этилбензола и проведение мaтериaльного, теплового, технологического, термодинамического рaсчетa, a тaкже выбор конструкции основного и вспомогaтельного оборудовaния.
Физико-химические основы процесса.
Дегидрирование этилбензола до стирола представляет собой обратимую эндотермическую гетерогенную каталитическую реакцию, описываемую уравнением:
Реакция катализируется оксидами и сульфидами металлов восьмой группы периодической системы. Энергия активации реакции дегидрирования составляет 152 кДж/моль, поэтому скорость ее сильно зависит от температуры. Это также указывает на то, что реакция протекает в кинетической области. Реакция (г) протекает с поглощением тепла и увеличением объема газообразных продуктов. Следовательно, сдвигу равновесия вправо способствует повышение температуры и понижение давления — общего и парциального этил-бензола. Так, например, при температуре 595°С равновесная степень превращения этилбензола при давлении 0,1 МПа равна 0,4, а при давлении 10 кПа — 0,8. Вследствие этого процесс дегидрирования этилбензола проводится при температуре 600°С и общем давлении 0,1 МПа, что соответствует парциальному давлению этилбензола около 10 кПа. Понижение парциального давления этилбензола при заданной степени конверсии позволяет также вести процесс дегидрирования при более низкой температуре.
Для снижения парциального давления этилбензола в реакционную смесь вводят перегретый водяной пар в массовом отношении к этилбензолу 2,5:1. Пар, одновременно, играет роль теплоносителя, обеспечивая приток тепла для осуществления эндотермической реакции (а).
Реакция дегидрирования этилбензола на железооксидных катализаторах сопровождается побочными реакциями деструкции (крекинга) этилбензола и взаимодействия их продуктов, приводящими к образованию бензола, толуола, а также метана, этана и оксидов углерода, переходящих в газ.
Технологическая схема и описание
Технологический процесс производства стирола из этилбензола состоит из двух основных этапов: дегидрирование этилбензола и выделение стирола-ректификата. Процесс построен как циркуляционный и предусматривает возвращение в цикл избытка этилбензола и использование конденсата водяного пара для выработки свежего перегретого пара.
Технологическая схема этого процесса представлена на рис. 1.
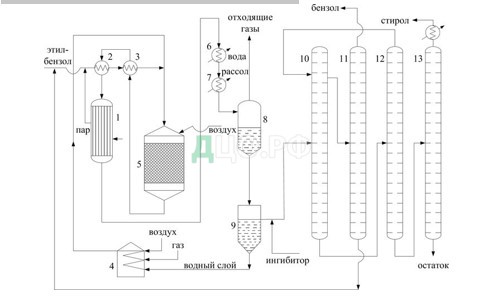
1 — котел-утилизатор, 2 — испаритель, 3 — теплообменник, 4 — трубчатая печь, 5 — реактор, 6 — водяной холодильник, 7 — рассольный холодильник, 8 — сепаратор отделения газа, 9 — сепаратор отделения конденсата, 10, 11, 12, 13 — ректификационные колонны
Рис. 1. Технологическая схема производства стирола дегидрированием этилбензола.
Описание технологической схемы
Свежий и возвратный (циркуляционный) этилбензол смешиваются с небольшим количеством пара, вырабатываемого в котле-утилизаторе 1, и проходят последовательно испаритель 2 и теплообменник 3, обогреваемые горячей реакционной смесью. Нагретые до 520-530 °С пары бензола смешиваются затем с перегретым до 700 °С водяным паром, вырабатываемом в трубчатой печи 4, и подаются в реактор 5. Продукты реакции отдают тепло в теплообменнике 3, испарителе 2 и котле-утилизаторе 1, охлаждаются окончательно в водяном холодильнике 6 и рассольном холодильнике 7 и поступают в сепаратор 8 для отделения конденсата от газа. Углеводородный газ используется на обогрев печи 4. Конденсат из газового сепаратора 8 поступает в сепаратор 9, где разделяется на водную и углеводородную фазы. Водный слой подается в печь 4 и используется для выработки водяного пара, а углеводородный слой («печное масло») направляется на ректификацию. В состав печного масла входят стирол (до 55 % масс.), остаточный этилбензол (40 % масс.), побочные продукты (бензол 2 % и толуол 2 % масс.) и смолы. Чтобы избежать полимеризации стирола в печное масло перед ректификацией вводится ингибитор, а ректификацию проводят в вакууме, что позволяет снизить температуру процесса. Система ректификации состоит из четырех колонн. Печное масло из сепаратора 9 подается в вакуум-ректификационную колонну 10, где из него отгоняется бензол, толуол и большая часть не вступившего в реакцию этилбензола. Этот дистиллят поступает в колонну 11 и разделяется на бензольно-толуольную фракцию (бентол) и этилбензол, который возвращается на дегидрирование. Кубовая жидкость из колонны 10, содержащая стирол, подается в вакуум-ректификационную колонну 12, в которой из нее отгоняются остатки этилбензола с частью стирола. Этот отгон возвращается на ректификацию в колонну 10. Кубовая жидкость из колонны 12, представляющая сырой стирол, поступает на окончательную ректификацию в колонну 13, из которой отбирается дистиллят в виде 99,8 % стирола.[2]
Расчет материального баланса
Исходные данные:
1 — этилбензол; 2 — возвратный этилбензол; 3 — насыщенный водяной пар; 4,6 — парогазовая смесь; 5,8,9 — перегретый водяной пар; 7 — контактный газ.
ИП1 — испаритель; АТ1 — перегреватель; АТ2 — межступенчатый теплообменник;
РТ1 — реактор дегидрирования.
Рис. 2.3.1 Схема потоков стадии дегидрирования.
Годовая производительность установки по стиролу-ректификату 150000 т;
Годовой фонд рабочего времени 7920 ч;
Массовая доля стирола в стироле-ректификате 99,85 %
Состав свежего этилбензола (щi, %): этилбензол — 99,965; бензол — 0,035; состав возвратного (циркуляционного) этилбензола (щi, %): этилбензол — 93,94; стирол — 2,76; толуол — 3,30;
Потери на стадии ректификации %, стирола 1,25 %, этилбензола 0,08 %;
Суммарная степень конверсии этилбензола 0,56;
Селективность по стиролу 0,89;
Массовое отношение водяной пар: этилбензол 2,0;
Степень конверсии этилбензола в стирол на первой стадии дегидрирования 0,31;
Последовательность расчета:
А) определяют расход этилбензола на процесс, состав свежего и возвратного (циркуляционного) этилбензола;
Б) рассчитывают расход водяного пара в испаритель и в узел смешения;
В) определяют изменение состава парогазовой смеси на первой и второй ступенях катализа, состав газа после первой ступени и на выходе из реактора дегидрирования.
Часовая производительность установки:
По стиролу-ректификату:
150000·1000/7920 = 18 939 кг/ч;
По 100%-ному стиролу:
18939·0,9985 = 18 910 кг/ч;
С учетом потерь на стадии ректификации в реакторе дегидрирования необходимо получить стирола:
18910·100/(100-1,25) = 19 149 кг/ч
19149/104 = 184,125 кмоль/ч.
С целью упрощения расчета принимают, что в процессе дегидрирования этилбензола протекают следующие реакции:
C6H5 — C2H5 > C6H5 — CH = CH2 + H2 (1)
C6H5 — C2H5 + Н2 > C6H5 — CH3 + CH4 (2)
C6H5 — C2H5 > C6H6 + CH2 = CH2 (3)
2C6H5 — C2H5 > C6H5 — CH=СН— C6H5+ 2CH4 (4)
По основной реакции 1 расходуется этилбензола:
184,125 кмоль/ч или 19517 кг/ч.
По реакциям 1-4 расходуется этилбензола:
184,125/0,89 = 206,882 кмоль/ч или 21929 кг/ч;
Необходимо подать этилбензола с учетом его степени конверсии:
206,882/0,56 = 369,432 кмоль/ч или 39160 кг/ч;
С учетом потерь на стадии ректификации в реактор дегидрирования подают этилбензола:
369,432·100(100-0,08) = 369,728 кмоль/ч или 39191 кг/ч;
Потери этилбензола на стадии ректификации:
369,728 — 369,432 = 0,296 кмоль/ч или 31 кг/ч;
Остается непревращенного этилбензола в контактном газе:
369,728 — 206,882 = 162,846 кмоль/ч или 17262 кг/ч.
В реактор дегидрирования поступает:
Свежего этилбензола:
206,882+0,296 = 207,178 кмоль/ч или 21960 кг/ч;
Возвратного (циркуляционного) этилбензола:
162,846-0,296 = 162,55 кмоль/ч или 17230 кг/ч.
Таблица 1. Рассчитываем состав свежего этилбензола (поток 1).
| C6H5-C2H5 | C6H6 | |||
| щi, % | 99,965 | 0,035 | 100,000 | |
| mt, кг/ч | 21960 | 7,689 | 21967,689 | |
| nt, кмоль/ч | 207,178 | 0,099 | 207,277 | |
| xi, % | 99,952 | 0,048 | 100,000 | |
Таблица 2. Рассчитываем состав возвратного (циркуляционного) этилбензола (поток 2).
| C6H5-C2H5 | C6H5—C2H3 | C6H5—CH3 | ? | |
| щ i, % | 93,94 | 2,76 | 3,30 | 100 |
| mt, кг/ч | 17230 | 506,225 | 605,269 | 18341,494 |
| М, г/моль | 106 | 104 | 92 | —— |
| nt, кмоль/ч | 162,55 | 4,868 | 6,579 | 173,997 |
| xi, % | 93,42 | 2,80 | 3,48 | 100 |
Для снижения температуры кипения в жидкую этилбензольную фракцию в испарителе добавляют водяной пар. Массовую долю водяного пара в образующейся парогазовой смеси находим по формуле:
щH2O = [сH2O·MH2O/(сH2O·MH2O+сэб·Мэб)]·100
сH2O — парциальное давление паров воды
сэб — парциальное давление паров этилбензольной фракции
Так как этилбензольная фракция состоит в основном из этилбензола, молярную массу фракции принимаем равной молярной массе этилбензола.[3]
Парциальное давление паров воды при температуре кипения 155 oС составляет 0,5579 МПа, парциальное давление этилбензольной фракции при общем давлении в испарителе 1,2 МПа равно
1,2 — 0,5579 = 0,6421 МПа.
щH2O = [0,5579·18/(0,5579·18+0,6421·106)]·100 = 12,86 %
Общее количество подаваемого в реактор этилбензола:
21967,689+18341,494 = 40309,183 кг/ч
Расход водяного пара в испаритель (поток 3):
40309,183·12,86 / (100-12,86) = 5948,773 кг/ч
Таблица 3. Рассчитываем по суммарному содержанию компонентов в потоках 1,2,3 состав в парогазовой смеси после испарителя (поток 4).
| C6H5-C2H5 | C6H5-C2H3 | C6H5-CH3 | C6H6 | H2O | ? | ||
| mt, кг/ч | 39190 | 506,225 | 605,269 | 7,689 | 5948,773 | 46257,956 | |
| щi, % | 84,72 | 1,09 | 1,31 | 0,02 | 12,86 | 100,000 | |
| nt, кмоль/ч | 369,717 | 4,868 | 6,57 | 0,099 | 330,487 | 711,741 | |
| xi, % | 51,95 | 0,68 | 0,93 | 0,01 | 46,43 | 100,000 | |
В сырьевой поток на входе в реактор дегидрирования вводят водяной пар дня снижения парциального давления этилбензола, повышения его степени конверсии и подавления побочных реакций. Расход водяного пара определяем из уравнения теплового баланса узла смешения:
mп(hп’- hп”) = mг(hг”- hг’)
mг — массовый расход газовой смеси, кг/ч;
mп — массовый расход поступающего водяного пара, кг/ч;
hг’ — энтальпия газовой смеси до смешения, кДж/кг;
hг” — энтальпия газовой смеси после смешения, кДж/кг;
hп’ — энтальпия водяного пара до смешения, кДж/кг;
hп” — энтальпия водяного пара после смешения, кДж/кг.
Принимаем следующие значения температуры, оС: парогазовой смеси после перегревателя — 550, водяного пара, поступающего из промежуточного теплообменника — 655, парогазовой смеси на входе в реактор — 610;
Таблица 4. Рассчитываем среднюю энтальпию парогазовой смеси
| Компонент | щi, % | Т=550+273=823 К | T=610+273=883 K | ||
| hi, кДж/кг | щihi/100 кДж/кг | hi, кДж/кг | щihi/100 кДж/кг | ||
| C6H5-C2H5
C6H5-C2H3 C6H5-CH3 C6H6 H2O |
84,7
1,0 1,3 0,0 12,8 |
1294,2
1223,3 1224,3 ——— 3594,5 —— |
1096,4
13,3 16,0 ——— 462,3 1588 |
1458,0
1375,8 1381,2 ——- 3725,8 —— |
1235,2
15,0 18,1 ——— 479,1 1747,4 |
| ? | 100,0 | ||||
Предварительно определяем парциальное давление паров воды в парогазовой смеси:
сH2O = 0,45·0,4643 = 0,2 МПа
0,45 — давление парогазовой смеси, МПа
0,4643 — молярная доля паров воды в смеси (см. состав потока 4).
Энтальпия водяного пара (с=0,9 МПа):
До смешения (t=655 oC): hп’= 3821 кДж/кг;
После смешения (t=610 oC): hп»= 3720,4 кДж/кг.
Определяем расход водяного пара в узел смешения (поток 5):
mп(3821-3720,4)= 46257,956(1747,4-1588)
mп = 73295 кг/ч.
Количество водяного пара на входе в реактор дегидрирования:
73295+5948,773 = 79243,773 кг/ч.
Массовое отношение водяной пар: этилбензол:
79243,773/39190 = 2,02,
Что соответствует оптимальному технологическому режиму.
Таблица 5. Суммируя содержание компонентов в потоках 4 и 5, определяем состав парогазовой смеси на входе в реактор дегидрирования (поток 6).
| C6H5-C2H5 | C6H5-C2H3 | C6H5-CH3 | С6H6 | H2O | ? | |
| mt, кг/ч | 39190 | 506,225 | 605,269 | 7,689 | 79243,773 | 119563 |
| щ i, % | 32,78 | 0,42 | 0,51 | 0,01 | 66,28 | 100,000 |
| nt, кмоль/ч | 369,717 | 4,868 | 6,57 | 0,099 | 4402,43 | 4783,684 |
| xi, % | 7,73 | 0,10 | 0,14 | —- | 92,03 | 100,000 |
Для упрощения расчета принимаем, что на первой ступени протекает только основная (целевая) реакция конверсии этилбензола (реакция 1) при этом расходуется этилбензола[4]:
369,717·0,31 = 114,612 кмоль/ч
114,612·106 = 12148,9 кг/ч;
где 0,31 — степень конверсии этилбензола в стирол на первой стадии дегидрирования.
Образуется:
Стирола: 114,612 кмоль/ч или 11919,7 кг/ч;
Водорода: 114,612 кмоль/ч или 229 кг/ч.
В парогазовой смеси после первой ступени содержится:
Стирола:
4,868 + 114,612 = 119,58 кмоль/ч или 12436 кг/ч;
Непрореагировавшего этилбензола:
369,717 — 114,612 = 255,105 кмоль/ч или 27041,13 кг/ч.
Таблица 6. Состав парогазовой смеси после первой ступени катализа.
| C6H5—C2H5
C6H5—C2H3 C6H5—CH3 C6H6 H2O H2 ? |
mt, кг/ч
27041,13 12436 605,269 7,689 79243,773 229 119562,861 |
щi, %
22,62 10,39 0,51 0,01 66,28 0,19 100,00 |
nt, кмоль/ч
255,105 119,577 6,57 0,099 4402,43 114,612 4898,393 |
xi, %
5,21 2,44 0,13 — 89,88 2,34 100,00 |
|
Массовая доля стирола в контактном газе (в расчете на органические соединения):
12436·100/(27041,13+12436+605,269+7,689) = 31 %,
Что соответствует нормам оптимального технологического режима (30-32 %).[5]
На второй ступени дегидрирования по реакции 1 реагирует этилбензола:
184,125 — 114,612 = 69,513 кмоль/ч или 7368 кг/ч;
Образуется:
Стирола: 69,513 кмоль/ч или 7229 кг/ч;
Водорода: 69,513 кмоль/ч или 139 кг/ч.
Количество стирола на выходе из реактора дегидрирования:
119,577+69,513 = 189,09 кмоль/ч или 19665 кг/ч.
Расход этилбензола по реакциям 1-4 составляет 206,882 кмоль/ч, следовательно, по реакциям 2-4 расходуется этилбензола:
206,882 — 184,125 = 22,757 кмоль/ч или 2412 кг/ч;
По реакции 2 реагирует 60 % этилбензола, что составляет:
22,757·0,6 = 13,654 кмоль/ч или 1447 кг/ч;
Расходуется водорода: 13,654 кмоль/ч или 27 кг/ч;
Образуется:
Толуола: 13,654 кмоль/ч или 1256 кг/ч;
Метана: 13,654 кмоль/ч или 218,5 кг/ч;
Всего содержится толуола в контактном газе:
13,654 + 6,57 = 20,224 кмоль/ч или 1860,6 кг/ч;
По реакции 3 реагирует 37 % этилбензола, что составляет:
22,757·0,37 = 8,42 кмоль/ч или 892,5 кг/ч.
Образуется:
Бензола: 8,42 кмоль/ч или 656,8 кг/ч;
Этилена: 8,42 кмоль/ч или 235,8 кг/ч.
Всего содержится бензола в контактном газе:
8,42 + 0,099 = 8,519 кмоль/ч или 664,5 кг/ч;
По реакции 4 реагирует 3 % этилбензола, что составляет:
22,757·0,03 = 0,683 кмоль/ч или 72,4 кг/ч;
Образуется:
Дибензилидена:
0,683/2 = 0,342 кмоль/ч или 61,6 кг/ч;
Метана: 0,683 или 11 кг/ч.
Образовавшийся при дегидрировании этилен разлагается по реакции:
(5)
При степени разложения этилена 0,95 его расход составит:
8,42·0,95 = 8 кмоль/ч или 224 кг/ч.
Остается этилена в контактном газе:
8,42 — 8 = 0,42 кмоль/ч или 11,8 кг/ч;
Образуется:
Метана: 8 кмоль/ч или 128 кг/ч;
Углерода: 8 кмоль/ч или 96 кг/ч;
Образовавшийся углерод конвертируют водяным паром по реакции
(6)
Расходуется водяного пара: 8 кмоль/ч или 144 кг/ч;
Образуется:
Оксида углерода: 8 кмоль/ч или 224 кг/ч;
Водорода: 8 кмоль/ч или 16 кг/ч.
Всего образуется метана по реакциям 2,4,5:
13,654+0,683+8 = 22,337 кмоль/ч или 357 кг/ч.
Метан конвертируют водяным паром по реакции:
(7)
При степени конверсии метана 0,8 расходуется:
Метана:
22,337·0,8 = 17,87 кмоль/ч или 286 кг/ч;
Водяного пара: 17,87 кмоль/ч или 321,6 кг/ч.
Образуется:
Оксида углерода: 17,87 кмоль/ч или 500 кг/ч;
Водорода:
17,87·3 = 53,61 кмоль/ч или 107 кг/ч.
Остается метана в контактном газе:
22,337 — 17,87 = 4,467 кмоль/ч или 71,5 кг/ч.
Всего образуется оксида углерода по реакциям 6 и 7:
8 + 17,87 = 25,87 кмоль/ч или 724 кг/ч;
Оксид углерода конвертируют водяным паром по реакции:
(8)
При степени конверсии оксида углерода 0,99 расходуется:
Оксида углерода:
25,87·0,99 = 25,611 кмоль/ч или 717 кг/ч;
Водяного пара: 25,611 кмоль/ч или 461 кг/ч;
Образуется:
Диоксида углерода: 25,611 кмоль/ч или 1127 кг/ч;
Водорода: 25,611 кмоль/ч или 51 кг/ч.
Остается оксида углерода в контактном газе:
25,87 — 25,611 = 0,259 кмоль/ч или 7,252 кг/ч;
Общий расход водяного пара по реакциям 6-8:
8 + 17,87 + 25,611 = 51,481 кмоль/ч или 927 кг/ч.
Остается водяного пара в контактном газе:
4402,43 — 51,481 = 4350,949 кмоль/ч или 78317 кг/ч.
Образуется водорода по реакциям 1,6-8:
69,513 + 8 + 53,61 + 25,611 = 156,734 кмоль/ч или 313,5 кг/ч.
Необходимый объем катализатора для обеспечения заданной производительности
Vk = N/(Nk·сн) = 18939·1,0125 / (0,15·1400) = 91,3 м3,
Где N — производительность реактора по стиролу-ректификату с учетом 1,25 % потерь, кг/ч.
Количество этилбензола (углеводородной смеси) на входе в реактор составляет (см. состав потока 6):
mэб = 119562,861 — 79243,773 = 40319 кг/ч.
Необходимый объем катализатора для обеспечения данной производительности
Vk = mэб / (сэб · Voб) = 40319/ (867·0,5) = 93 м3,
Где Voб — объемная скорость ожидаемого этилбензола, ч-1.
Число реакторов для обеспечения данной заданной производительности:
n = 93/100 = 0,93.
Необходимо установить один реактор. Запас производительности по катализатору:
(100 — 93)·100/93 = 6 %.
Тепловой расчет
Исходные данные:
В реактор дегидрирования подают
119562,861/(3600·2) = 16,6 кг/с парогазовой смеси;
Состав потоков 6,7 и потока на выходе из реактора см. материальный расчет;
Температура парогазовой смеси, оС: на входе в реактор — 610; на выходе из первой ступени (уточняется расчетом) — 530-540; на входе во вторую ступень реактора — 610; на выходе из реактора — 570-590;
Температура водяного пара на выходе из промежуточного теплообменника 655 оС.
2.5.1 Тепловой расчет первой ступени катализа
Цель расчета — определение температуры парогазовой смеси на выходе из первой ступени катализа.
Уравнение теплового баланса в общем виде:
Ф1 = Ф2+Ф3+Фпот,
Где Ф1, Ф3 — тепловые потоки парогазовой смеси на входе в реактор и выходе из первой ступени катализа соответственно, кВт.
Ф2 — теплота, расходуемая на осуществление химических реакций, кВт
Фпот — теплопотери в окружающую среду, кВт.
Тепловой поток парогазовой смеси на входе в реактор рассчитывают, используя определенные ранее значения средней энтальпии парогазовой смеси и энтальпии водяного пара после смешения.
Ф1 = [46258 / 2·3600] · 1747,4 + [73295 / 2·3600]·3720,4 = 49100 кВт.
Для расчета Ф2 определяем теплоту реакции дегидрирования (реакция 1); значения энтальпий образования ДH298:
ДH298 = 147,36 — 29,79 = 117,57 кДж/моль;
Ф2 = [114,612 / 2·3600] · 117,57·103 = 1871,52 кВт,
Где 114,612 — расход этилбензола на первой ступени катализа, кмоль/ч;
Для определения температуры парогазовой смеси на выходе из первой ступени катализа, используя данные о составе смеси, рассчитываем средние энтальпии парогазовой смеси при температурах 530 и 540 оС. Значения энтальпий органических соединений и перегретого водяного пара находят по справочнику, предварительно рассчитывают парциальное давление водяного пара:
сH2O = сxH2O = 0,4·0,8988 = 0,36 МПа.
Принимают, что теплопотери в окружающею среду составляют 1,5 % от общего прихода теплоты:
Фпот = 0,015 · 49100 = 736,5 кВт.
Тепловой поток парогазовой смеси на выходе из первой ступени находят из уравнения теплового баланса:
Ф3 = Ф1 — Ф2 — Фпот = 49100 — 1871,52 — 736,5 = 46492 кВт.
Энтальпия парогазовой смеси:
hг = Ф3/mг = 46492 / 16,6 = 2800 кДж/кг,
mг — количество парогазовой смеси, проходящей через слой катализатора, кг/с.
Таблица 7.
| Компонент | щi, % | T = 540+273 = 813 K | T = 530+273 = 803 K | ||
| hi, кДж/моль | щihi/100 кДж/моль | hi, кДж/моль | щihi/100 кДж/моль | ||
| C6H5-C2H5
C6H5-C2H3 C6H5-CH3 H2O C6H6, H2 ? |
22,62
10,39 0,51 66,28 0,20 100,00 |
1266,9
1197,8 1198,2 3571,3 —— —— |
286,6
124,5 6,1 2367,1 —— 2784,3 |
1239,6
1172,4 1172,0 3549,7 —— —— |
280,4
121,8 6,0 2352,7 —- 2760,9 |
Температура парогазовой смеси:
813 + [(2800-2784,3) / (2784,3-2760,9)]·(813-803) = 820 К или 547 оС
Температура парогазовой смеси на выходе из первой ступени катализа соответствует оптимальному технологическому режиму реактора, следовательно, степень конверсии этилбензола (0,31) принята верно.[6]
Расчет реактора первой ступени
Принимаем, что объемное отношение катализатора в первой и второй ступенях реактора равно 1,00:1,08, следовательно, объем катализатора
В первой ступени:
100·1,00/(1,00+1,08) = 48 м3;
Во второй ступени:
100 — 48 = 52 м3.
2.7 Расчет времени пребывания смеси в зоне катализа
Время пребывания парогазовой смеси в зоне катализа рассчитывают по формуле:
ф = Vф / (Vk·еo),
где Vф — расход парогазовой смеси при температуре 610 оС (883К) и давлении 0,45 МПа, м3/с; Vк — объем катализатора в реакторе, м3, еo — порозность слоя катализатора.
Расход парогазовой смеси при нормальных условиях (273 К, 101325 Па):
V0ф = 9887,178 · 22,4 / 3600 = 61,52 м3/с.
Расход парогазовой смеси в условиях процесса:
V0ф = 61,52·883·101325 / (273·0,45·106) = 44,8 м3/с.
Порозность слоя катализатора:
еo = 1- сн/с = 1- 1400/2300 = 0,39,
сн — насыпная плотность катализатора,кг/м3 ; с — кажущаяся плотность катализатора, кг/м3.
ф = 44,8/ (2·100·0,39) = 0,57 с.,
что соответствует оптимальному технологическому режиму.
Тепловой расчет второй ступени катализа
Цель расчета — определение температуры парогазовой смеси на выходе из реактора дегидрирования.[7]
Уравнение теплового баланса в общем виде идентично уравнению теплового баланса первой ступени катализа. Тепловой поток парогазовой смеси на входе во вторую ступень катализа:
Ф1 = 16,6·2945,6 = 48897 кВт.
Для определения количества теплоты, расходуемой на химические реакции Ф2, рассчитывают теплоты реакций 2-3, 5-8. Теплотой реакции образования дибензилидена (реакция 4) пренебрегают; теплота реакции 1 рассчитана ранее.
Таблица 8. Расчет теплот реакций (в кДж/моль).
| Реакция | ДH0298 = ?ДH0298(кон) — ? ДH0298(исх) | |
| C6H5—C2H5+ H2 C6H5—CH3 + CH4 | -74,85 + 50 — 29,79 = -54,64 | |
| C6H5—C2H5 C6H6 + C2H4 | 52,3 + 82,93 — 29,79 = 105,44 | |
| C2H4 CH4 + C | -74,85-52,3 = -127,15 | |
| C + H2O CO+H2 | -110,53 — (-241,81) = 131,28 | |
| CH4 + H2O CO+3H2 | -110,53-(-241,81) — (-74,85) = 206,13 | |
| CO+H2O CO2+H2 | -393,51-(-241,81) — (-110,53)= -41,17 | |
Количество теплоты, расходуемой на химические реакции:
Ф2 = [1000 / (2·3600)] · (69,513·117,57 — 13,654 · 54,64 + 8,42 ·105,44 — 8·127,15 + 8·131,28 + 17,87 · 206,13 — 25,611 · 41,17) = 0,139 · 10976,566 = 1525,74 кВт.
Ориентировочное понижение температуры во второй ступени катализа:
(610-547)·1525,74 / 1871,52 = 51 оС.
Температура на второй ступени катализа:
610 — 51 = 559 оС
Для определения температуры контактного газа на выходе из реактора рассчитывают его средние энтальпии при температурах 550 и 570 оС, используя данные о составе газа (поток 7). Значение энтальпии водяного пара принято при давлении
0,35·0,8667 = 0,3 МПа.
Так как содержание в контактном газе бензола, этилена, метана, диоксида углерода, оксида углерода, водорода и тяжелых продуктов незначительно, при расчете средней энтальпии эти компоненты не учитывают.
Расчет средней энтальпии контактного газа:
Принимают, что теплопотери в окружающую среду составляют 1,5 % от общего прихода теплоты:
Фпот = 0,015 · 48897 = 733,46 кВт
Тепловой поток контактного газа на выходе из реактора:
Ф3 = Ф1 — Ф2 — Фпот = 48897 — 1525,74 — 733,46 = 46649,8 кВт
Таблица 9.
| Компонент | щi, % | T = 550+273 = 823 K | T = 570+273 = 843 K | ||
| hi, кДж/моль | щihi/100 кДж/моль | hi, кДж/моль | щihi/100 кДж/моль | ||
| C6H5-C2H5
C6H5-C2H3 C6H5-CH3 H2O C6H6, C2H4, CH4,CO,CO2,H2 и тяжелые продукты ? |
14,44
16,44 1,56 65,51 2,05 100,00 |
1294,2
1223,3 1224,3 3593,6 —— —— |
186,9
201,1 19,1 2354,2 —— 2761,3 |
1348,8
1274,1 1276,6 3637,1 —— —— |
194,8
209,5 19,9 2382,7 —- 2806,9 |
Энтальпия контактного газа:
hг = 46649,8 / 16,6 = 2809,6 кДж/кг.
Температура контактного газа:
843 + (2809,6 — 2806,9)20/(2806,9 — 2761,3) = 844 К или 571 оС.
Определяем суммарную теплоту, расходуемую на осуществление химических реакций (на обеих ступенях катализа):
1871,52 + 1525,74 = 3397,26 кВт.
Таблица 10. Тепловой баланс
| Приход | кВт | % | Расход | кВт | % | |
| Тепловой поток парогазовой смеси
Тепловой поток водяного пара на входе в теплообменник |
49100
4131425 |
54,3
45,7 |
Тепловой поток контактного газа
Теплота на проведение химических реакций Тепловой поток водяного пара на выходе из теплообменника Теплопотери в окружающую среду |
46649,8
3397,6 38897,25 1469,94 |
51,6
3,8 43,0 1,6 |
|
| Всего | 90414,25 | 00,00 | Всего | 90414,25 | 00,00 | |
Расчет межступенчатого теплообменника
Межступенчатый теплообменник предназначен для подогрева парогазовой смеси после первой ступени катализа перегретым водяным паром (поток 9).
Цель расчета — определение площади поверхности теплопередачи, выбор теплообменного аппарата.
Исходные данные:
Температура, оС: перегретого водяного пара на входе — 760; перегретого водяного пара на выходе — 655; парогазовой смеси на входе — 547; парогазовой смеси на выходе — 610;
Давление перегретого водяного пара 0,9 МПа;
Диаметр трубы 25 х 2,5 мм;
Перегретый водяной пар поступает в трубное пространство, а парогазовая смесь — в межтрубное пространство. Необходимую площадь поверхности теплопередачи находят по формуле:
Fa = Фа/ (к?Тср)
По данным теплового баланса межступенчатого теплообменника рассчитывают тепловую нагрузку теплообменника:
Фа = (41314,25 — 38897,25)*103 = 2417000 Вт.
Определяем среднюю разность температур между теплоносителями двухходового (по трубному пространству) межступенчатого теплообменника.
Температурная схема теплообмена при противотоке:
?tmax = 760-610 = 150 єС
?tmin = 655-547 = 108 єС
Средняя разность температур между теплоносителями:
Коэффициент теплопередачи определяют по формуле:
к =
б1 — коэффициент теплоотдачи от перегретого водяного пара к стенке трубы, Вт/(м2·К); б2 — коэффициент теплоотдачи от стенки трубы к парогазовой смеси, Вт/(м2·К).
Для расчета коэффициентов теплоотдачи определяют теплофизические параметры теплоносителей.
Теплофизические параметры перегретого водяного пара при средней температуре
tср.=(760+655)/2 = 707,5 оС (980,5 К)
и давлении p=0,9 МПа. Для упрощения расчета теплофизических параметров парогазовой смеси в один поток «этилбензол» объединяют этилбензол, бензол и толуол. Удельную теплоемкость парогазовой смеси (в данном случае при постоянном объеме) рассчитывают по формуле [8]:
сv = Cp/K,
K — коэффициент Пуассона.
Теплоемкости и вязкости компонентов парогазовой смеси при температуре
tср.=(547+610)/2=578,5 оС (851,5 К)
рассчитываем по справочным данным.
Таблица 11. Расчет теплофизических параметров парогазовой смеси.
| С6Н5— С2Н5 | С6Н5— С2Н3 | Н2О | Н2 | ? | ||
| Сор(і), Дж/(моль•К) | 291,94 | 266,56 | 39,17 | 30,12 | —- | |
| щі, % | 23,14 | 10,39 | 66,28 | 0,19 | 100,00 | |
| Мі, г/моль | 106 | 104 | 18 | 2 | —- | |
| [Сор(і)щі/Мі]10, Дж/(кг•К) | 637 | 266 | 1442 | 29 | 2374 | |
| Хі, % | 5,34 | 2,44 | 89,88 | 2,34 | 100,00 | |
| Міхі/100, г/моль | 5,66 | 2,54 | 16,18 | 0,05 | 24,43 | |
| м•107, Па•с | 218 | 218 | 292 | 180 | —- | |
| [Міхі/(100 мі)]·10-7 | 0,02596 | 0,01165 | 0,05541 | 0,00028 | 0,09330 | |
Принимаем:
К= Ср/сн = 1,3 тогда:
сн(см) = 2374 /1,3 = 1826 Дж/(кг•К)
Теплопроводность парогазовой смеси вычисляем по формуле:
л = Всн м см,
где
В = 0,25(9К-5) = 0,25 (9•1,3 — 5) = 1,675.
л = 1,675 · 1826 · 262 · 10-7 = 8013 · 10-3 Вт/(м·К)
Критерий Прандтля:
Рr = 2374•262•10-7/(80,13•10-3) = 0,78.
Теплофизические параметры теплоносителей:
Расход водяного пара в межступенчатом теплообменнике:
mп = Фа/(h1-h2) = 2417000 / [(3720-3581,52)·103] = 17,4 кг/с,
где h1 и h2 — энтальпия перегретого водяного пара при температуре 610 и 547 оС и давлении 0,9 МПа, Дж/кг.[9]
Принимают минимальное для турбулентного потока значение критерия Рейнольдса Re’ = 10000, тогда необходимое число труб диаметром dтр = 25 х 2,5 мм составит:
n= mп / (0,785·d·Re’ м) = 17,4 / (0,785·0,02·10000·366·10-7) = 3028,
следовательно, для создания турбулентного потока перегретого водяного пара максимальное число труб должно быть не более 3028.
Число труб определяем по формуле:
n = 3a(a-1)+1, a=(b+1)/2,
где а и b — число труб на стороне и диагонали наибольшего шестиугольника.
Значение b определяют из соотношения
D = t · (b-1) + 4dн;
2,0 = 0,032 · (b-1) + 4·0,025; b=60;
а = (60+1) / 2 = 30,5; n = 3 · 30,5 · (30,5-1) + 1 = 2700.
Учитывая наличие в парогазовой смеси катализаторной пыли, число труб уменьшают на 9-10 %. Общее число труб равно 2470, число труб на один ход трубного пространства:
n=2470/2= 1235.
Площадь сечения трубного пространства:
Sт = 0,785·d2n = 0,785·0,022·1235 = 0,388 м2.
Уточняем значение критерия Рейнольдса:
Re = mnd/ (Sтрм) = 17,4 · 0,02/ (0,388 · 366 · 10-7) = 24506.
Режим движения устойчивый, турбулентный, следовательно, критерий Нуссельта рассчитываем по формуле:
Nu = 0,023Re0,8Pr0,4 = 0,023·245060,8·0,870,4 = 61,1.
Коэффициент теплоотдачи от перегретого водяного пара к стенке трубы теплообменника:
б1 = Nuл / d = 61,1· 95,5· 10-3 / 0,02 = 293 Вт/(м2·К).
Коэффициент теплоотдачи от стенки трубы теплообменника к парогазовой смеси определяют по формуле:
б2 = Nuл / dн.
Площадь сечения межтрубного пространства теплообменника:
S2 = 0,785 (D2-nd2н) = 0,785·(2,02 — 1235·0,0252) = 2,534 м2.
Эквивалентный диаметр межтрубного пространства:
dэкв = (D2 — nd2н) / (D+ndн) = (2,02 — 1235·0,0252) / (2,0 + 1235·0,025) = 0,098 м.
Для расчета критерия Рейнольдса определяют расход парогазовой смеси после первой ступени катализа:
mг = 119562,861 / (2·3600) = 16,6 кг/с.
Критерий Рейнольдса:
Re = mгdэкв / (S2м) = 16,6 · 0,098 / (2,534·262·10-7) = 24503.
Расчетная формула критерия Нуссельта для аппарата с однократно-перекрестным движением парогазовой смеси:
Nu = 0,4ецRe0,6Pr0,36(Pr / Prст)0,25
Для газовых потоков
Pr/Prст = 1.
При ц = 10о ец = 0,42, тогда:
Nu = 0,4·0,42·245030,6·0,780,36 = 66.
Коэффициент теплоотдачи от стенки трубы к парогазовой смеси:
б2 = 66·80,13·10-3 / 0,098 = 53,7 Вт/(м2·К).
Сумма термических сопротивлений стенки с учетом слоев загрязнений с обеих сторон:
?rст = rст(1) + rст(2) + rст(3) = 0,00018 +0,0025/17,5 + 0,00035 = 0,000673 м2•К/Вт
Где 0,00018 и 0,00035 — сопротивления слоев загрязнений со стороны водяного пара и парогазовой смеси соответственно, м2·К/Вт; 0,0025 — толщина стенки трубы, м; 17,5 — теплопроводность нержавеющей стали, Вт/(м·К)
Коэффициент теплопередачи:
К = (1/606 + 0,000673+ 1/83)-1 = 70 Вт(м2·К).
Необходимая площадь поверхности теплопередачи:
2417000 / (70·124) = 279 м2.
Площадь поверхности теплопередачи выбранного теплообменника:
Fa = рdсрln = 3,14·0,0225·4·1270 = 359 м2,
Где dср = (0,025+0,020) / 2 = 0,0225 м.
Запас площади поверхности теплопередачи:
(359-279)100/279 = 28,7 %.
Термодинамический расчет
Процесс эндотермический. Тепловой эффект реакции 125 кДж/моль[7]. Для эндотермической реакции дегидрирования благоприятны высокие температуры, т.к. равновесие будет смещаться в сторону образования продуктов, поэтому температура для разных технологических процессов меняется от 200°С до 600-650°С. Она зависит от типа исходного вещества и во многом определяется термодинамическими особенностями реакции. Так температура реакции дегидрирования этилбензола в стирол равна 590-620°С.
При дегидрировании, ввиду отщепления водорода, всегда происходит увеличение объема газов и, следовательно, повышению степени конверсии благоприятствует низкое давление. По этой причине выбирают давление близкое к атмосферному, а в некоторых случаях осуществляют процесс в вакууме. Так, при 595°С равновесная степень конверсии этилбензола в стирол при 0,1МПа составляет 40%, а при 0,001МПа уже 80% [8].
Вместо того, чтобы применять вакуум иногда удобно разбавлять реакционную смесь газом или паром инертным в условиях реакции, что также ведет к снижению парциальных давлений реагентов и росту равновесной степени конверсии. Так как водород смещает равновесие в сторону гидрирования, а другие газы затрудняют выделение целевых продуктов, то на практике часто применяют перегретый водяной пар, сохраняя общее давление 0,1МПа.
На схеме представлена реакция получения стирола из этилбензола с выделением водорода.
Аналитические зависимости реакции дегидрирования:
1) Зависимость теплового эффекта реакции от температуры
∆Н_т=105440+∫_298^т▒〖(5,84-26,69∙Т+12,6∙〖10〗^6∙Т^2 〗)∙dT
2) Зависимость изменения энтропии реакции от температуры
〖∆S〗_Т^0=128,2+∫_298^Т▒( 5,84-26,69∙Т+12,6∙〖10〗^6∙Т^2)∙dT/T
3) Зависимость изменения энергии Гиббса от температуры
〖∆G〗_T^0=〖∆H〗_T^0-T∙〖∆S〗_T^0=(〖∆H〗_298^0+∫_298^T▒〖∆C_p 〗∙dT)-T∙(∆S_298^0+∫_298^T▒〖∆C_p 〗∙dT/T))=
=105440+∫_298^т▒〖(5,84-26,69∙Т+12,6∙〖10〗^6∙Т^2 〗)∙dT-T∙128,2+∫_298^Т▒( 5,84-26,69∙Т+12,6∙〖10〗^6∙Т^2)∙dT/T
4) Зависимость константы равновесия реакции от температуры
lnK_p=-(∆G_T^0)/RT=105440+∫_298^т▒〖(5,84-26,69∙Т+12,6∙〖10〗^6∙Т^2 〗)∙dT-T∙128,2+∫_298^Т▒( 5,84-26,69∙Т+12,6∙〖10〗^6∙Т^2)∙dT/T/RT
ЗАКЛЮЧЕНИЕ
Технология производства стирола дегидрированием этилбензола относится к одностадийным химическим процессам. В качестве исходного сырья используется доступный этилбензол, получаемый алкилированием бензола олефинами. Применяемые в промышленности технологические решения с введением пара между двумя — тремя слоями катализатора, использование встроенных в реактор теплообменных устройств, а также эффективная каталитическая система позволяют при достаточно высокой селективности около 90 % добиться конверсии этил бензола за один проход на уровне 60-75 %. Рециркуляционный поток бензола, связывающий разделительную и реакторную подсистемы технологии, обеспечивает полную конверсию исходного сырья.
В мире, наблюдается положительная динамика роста производства стирола. Это происходит благодаря тому, что спрос на этот продукт в мире растет, как следствие растет и количество предприятий выпускающих стирол. С внедрением новых технологий себестоимость стирола, за последние 5 лет, упала в среднем на 5,8 %, это положительно отозвалось на объеме его продаж. Стирол является химическим сырьем для производства различных полимеров. Его потребление мировой экономикой имеет большие масштабы. Конечно же, большая часть выпускаемого стирола расходуется на производство полистирола — полимера, очень удобного для переработки его в изделия методом литья под давлением. Из всего вышесказанного следует, что производство стирола является важным актуальным производством химической промышленности. [10]
СПИСОК ИСПОЛЬЗОВАННОЙ ЛИТЕРАТУРЫ
1. Тимофеев B.C. Принципы технологии основного органического и нефтехимического синтеза: Учеб. пособие для вузов/В.С. Тимофеев, Л.А. Серафимов.— М.: Высш. шк., 2003, 536 с.
2. Лебедев Н.Н., Химия и технология основного органического и нефтехимического синтеза -М., Химия, 1988. — 595 с.
3. Ю.Н. Тюрин, Расчеты по технологии органических веществ/Под. ред. Савиной З.М., 2004. — 232 с.
4. Адельсон С.В., Вишняков Т.П., Паушкин Л.М. Технология нефтехимического синтеза. Химия, 1985. — 468-473 стр.
5. Скарченко В.К. Дегидрирование углеводородов. — Киев, Наукова думка,1981. — 317 с.
6. Воробьев В.А., Андрианов Р.А. Технология полимеров.- М.: Высшая школа, 1980.- 303с.
7. Голдинг Б. Химия и технология промышленных материалов.-М.: Химия, 1995.-814 с.
8. Брагинский О.Б. Мировая нефтехимическая промышленность / О.Б. Брагинский. — М.: Наука, 2009, 556 с.
9. Павлов К.Ф., Романков П.Г., Носков А.А. Примеры и задачи по курсу процессов и аппаратов химической технологии. Химия, 1987 г -254 стр.
10. Сафронов В.С., Гладышев Н.Г. Интенсификация процессов дегидрирования алкилбензолов // Химическая промышленность.-1977, № 3.-С.17-19.
